-
شنبه, ۱۷ تیر ۱۴۰۲، ۰۶:۱۰ ب.ظ
-
۶۰
مروری بر تثبیت آنزیم ها با استفاده از نانوالیاف ساخته شده توسط الکتروریسی
چکیده:
عملکرد آنزیم تثبیت شده به نوع بستر و روش تثبیت بستگی دارد. نانوساختارها به علت مزایایی که در مورد تثبیت آنزیم دارند به عنوان بستر خوبی برای آنزیم در نظر گرفته میشوند. از جمله مزایای نانوساختارها برای تثبیت میتوان به بارگذاری آنزیمی موثر، حداقل رساندن سختی دسترسی سوبسترا به آنزیم و نسبت سطح به حجم بالای آنها که منجر به فعالیت بیولوژیکی بالاتر میشود اشاره کرد. در مقایسه با سایر بسترهای نانو (مانند سیلیس و نانوذرات)، نانوالیاف به دلیل تخلخل و اتصال متقابل بالا و قابلیت استفاده مجدد به علت جداسازی آسان از مخلوط واکنش به عنوان بستر برای تثبیت آنزیم، نتایج امیدوارکنندهای را ارائه میدهند. در این مقاله عمدتاً پیشرفتهای اخیر در استفاده از نانوالیاف به عنوان بستر برای تثبیت آنزیم با دو روش اصلی، انکپسولاسیون و اتصال سطحی مورد بحث قرار گرفته است. انکپسولاسیون به معنای الکتروریسی مخلوطی از آنزیم و پلیمر است. اتصال سطحی به جذب فیزیکی، اتصال کووالانسی یا اتصال عرضی آنزیمها بر روی نانوالیاف ساده یا اصلاحشده اشاره دارد. در این مقاله مقایسه دقیقی بین این دو روش تثبیت انجام شده و مزایا و معایب هر روش مورد بررسی قرار گرفته است.
واژه های کلیدی: آنزیم، الیاف، الکتروریسی، نانوتکنولوژی
مقدمه:
آنزیمها، کاتالیزورهای بیولوژیکی ماکرومولکولی هستند که واکنشهای بیوشیمیایی و شیمیایی را تسریع میکنند، به دلیل کارایی کاتالیزوری بالا و ویژگی عملکردی سوبسترا در شرایط واکنش ملایم ( دما ،pH و فشار ملایم) به طور گسترده در زمینههای مختلف مورد استفاده قرار می گیرند. مشکل عمده آنزیمهای محلول، ماندگاری بسیار کم آنها و عدم استفاده مجدد از آنها میباشد.
عوامل خارجی مانندpH ، دما، فشار، حلالهای آلی، قدرت یونی بالای محیط یا پروتئازها، ساختار آنزیم را ناپایدار کرده و منجر به کاهش فعالیت کاتالیزوری آنها میشوند (1). چنین نقصهایی را میتوان با تثبیت آنزیم برطرف کرد.
برای مقابله با چالش های اساسی آنزیم های محلول، از چهار دهه پیش تثبیت به عنوان یک راه حل بسیار کارآمد مطرح شده است. بطور خلاصه، تثبیت آنزیم به فرآیندی که آنزیم در موضع یا فضای مشخص و جامد محدود شده و فعالیت کاتالیزوری آن حفظ شده و میتواند به صورت مکرر و مداوم استفاده شود، گفته میشود (2).
مزایای تثبیت:
استفاده از آنزیم تثبیت شده نسبت به آنزیم محلول مزایای زیادی دارد از جمله:
- قابلیت بازیابی و استفاده مجدد آنزیم در یک واکنش کاتالیزوری جدید و در نتیجه کاهش هزینه فرآیند صنعتی
- پایداری طولانی مدت آنزیم تثبیت شده
- افزایش مقاومت به شرایط محیطی از جمله دما، pH و حلالهای آلی
- عدم آلودگی محصول توسط آنزیم به علت جداسازی از محیط واکنش (خصوصاً در فناوریهای غذایی)
- استفاده در فرآوریهای پیوسته و مداوم
- امکان توقف سریع واکنش با جداسازی آنزیم تثبیت شده
- جلوگیری از تجمع آنزیمها
- کاهش اثر بازدارندگی توسط محصولات واکنش بر فعالیت آنزیم (3و 4)
معایب تثبیت:
با وجود مزایای کاربرد آنزیم تثبیت شده، ممکن است معایبی در برخی روشهای تثبیت نیز مشاهده شود مانند:
- هزینه بالای برخی روشهای تثبیت
- کاهش فعالیت آنزیم بعد از تثبیت به علت دناتوراسیون یا غیرفعال شدن تحت شرایط نامناسب
- ممانعت فضایی و محدودیتهای انتقال جرم
- تغییرات نامطلوب در ویژگیهای آنزیم ها (2 و 3).
لازم به ذکر است که عملکرد آنزیمهای تثبیت شده عمدتاً به ساختار و مورفولوژی بستر یا حامل مورد استفاده بستگی دارد. خصوصیات بستر یا حامل میتواند به طور مستقیم بر فعالیت کاتالیزوری آنزیمهای تثبیت شده تأثیر بگذارد. در سالهای اخیر
محققان مطالعات گستردهای را بر روی تثبیت آنزیمها با استفاده از مواد حامل مختلف، از جمله کربن فعال، نانوذرات، هیدروژل ها، میکروذرات مغناطیسی، ساختارهای متخلخل و غشاهای میکروفیلتراسیون آبدوست و غیره انجام دادهاند (5-7). در میان همه این بسترها و حامل ها، اخیرا نانوساختارها، بسیار مورد توجه محققین قرار گرفتهاند.
نانوتکنولوژی و تثبیت آنزیم
امروزه نانومواد به دلیل تغییرات مطلوب در ویژگیهای فیزیکی، شیمیایی و بیولوژیکی در مقایسه با همتایان آنها در مقیاسهای بزرگتر، در طیف گستردهای از کاربردهای پزشکی، دارویی و غذایی مورد استفاده قرار میگیرند. همچنین نانوساختارها به علت مزایایی که در مورد تثبیت آنزیم دارند به عنوان بستر خوبی برای آنزیم در نظر گرفته میشوند. از جمله مزایای نانوساختارها برای تثبت میتوان به بارگذاری آنزیمی موثر، حداقل رساندن سختی دسترسی سوبسترا به آنزیم، استحکام مکانیکی بالا و نسبت سطح به حجم بالای آنها که منجر به فعالیت بیولوژیکی بالاتر میشود اشاره کرد (8). در مطالعهای که توسط زائو و همکاران انجام شد حامل های کیتوزان در مقیاس ماکرو، میکرو و نانو از نظر فعالیت آنزیمی مقایسه شدند، نتایج نشان داد که نانوسیستم، بالاترین فعالیت آنزیمی را ارائه میدهد (9). مطالعات زیادی در زمینه استفاده از نانوساختار برای تثبیت آنزیمها انجام شده است. سیلیس-نانومتخلخل، نانولولهها، نانوذرات و نانوالیاف از جمله پرکاربردترین بسترهای نانوساختاری آنزیمها هستند.
علاوه بر اثرات مثبت، برخی از مواد با اندازه نانو محدودیتهای خاص خود را دارند. به عنوان مثال، سیلیس نانومتخلخل، مولکول آنزیم را در منافذ داخلی خود محصور میکند. انتشار انبوه سوبسترا و محصول را محدود میکند. در نتیجه تولید آنزیمی کاهش مییابد (10 و 11). اگرچه نسبت سطح به حجم در نانوذرات نسبت به سایر نانوساختارها بیشتر است و مواد نانو غیرمتخلخل مانند نانولولهها انتقال جرم بالاتری را ارائه میدهند (12). با این حال، تولید نانوذرات در مقیاس انبوه دشوار است و هزینه تولید میتواند بسیار بالا باشد. همچنین بازیافت و استفاده مجدد نانوذرات از محیط واکنش زمانی که از نانوذرات مغناطیسی استفاده نمیشود، دشوار است (13). بنابراین، کاربرد نانوذرات برای اهداف صنعتی را سخت میکند. در مقابل اینها، نانوالیاف دارای ویژگیهای امیدوارکنندهای هستند که میتوانند بر این مشکلات غلبه کنند.
نانوالیاف
یکی از مهمترین نانوساختارها، نانوالیاف میباشند که اخیرا به علت نسبت سطح به حجم بسیار بالای آنها، خواص مکانیکی بهتر، اندازه منافذ کوچک و قابلیت استفاده مجدد به علت جداسازی آسان از مخلوط واکنش برای کاربردهای مختلف مورد توجه ویژهای قرار گرفتهاند (14). روشهای مختلفی مانند جداسازی فاز (15) استخراج (16)، الگوسازی (17) و .... و اخیرا الکتروریسی برای تولید نانوالیاف وجود دارد. در میان این روشها، الکتروریسی یک تکنیک برتر بوده و از اهمیت ویژهای برخوردار است چرا که دارای ویژگیهای عملیاتی نسبتا آسان، مقرون به صرفه بودن، تولید الیاف با قطر یکنواخت که به راحتی با سایر روشهای معمولی تهیه الیاف قابل دستیابی نیست، میباشد (18).
الکتروریسی
اصطلاح الکتروریسی از "نخریسی الکترواستاتیکی[1]" گرفته شده (19)، که یک فرآیند الکتروهیدرودینامیک است که با استفاده از نیروی الکترواستاتیک محلول پلیمری را به الیاف پیوسته میکرو یا نانو تبدیل میکند (20). دستگاه الکتروریسی از سه قسمت اصلی: منبع تغذیه با ولتاژ بالا، پمپ سرنگ و جمع کننده[2] تشکیل شده است (8). ابتدا یک قطره از محلول پلیمری از سر سرنگ با سرعت ثابت خارج میشود. سپس با اعمال ولتاژ بالا به محلول پلیمری، در اثر نیروی الکترواستاتیکی که بین نوک سرنگ (به عنوان قطب مثبت) و جمع کننده (به عنوان قطب منفی) ایجاد میشود، قطره کشیده میشود (21) و به حالت مخروطی شکل تبدیل میشود که اصطلاحا به آن مخروط تیلور[3] گفته میشود (22). زمانی که نیروی میدان الکتریکی به حدی برسد که بر کشش سطحی محلول غلبه کند، جتی[4] متشکل از الیاف ریز از نوک مخروط تیلور خارج میشود. همانطور که جت الیاف به سمت جمع کننده حرکت میکند، حلال تبخیر شده و الیاف پلیمری جامد بر روی جمع کننده قرار میگیرند (20). پمپ تزریق و جمع کننده در یک راستا میباشند و معمولاً به صورت عمودی یا افقی در مقابل هم قرار میگیرند.
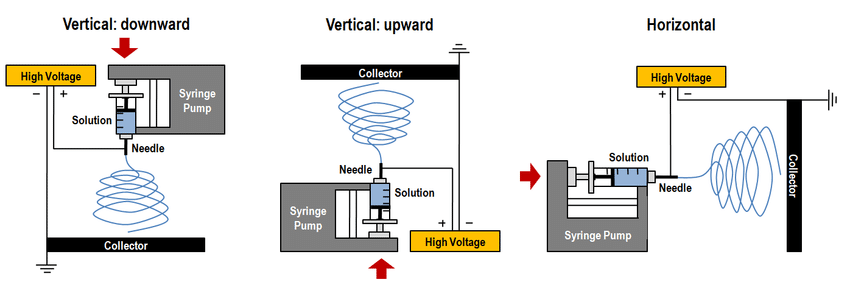
شکل (1) انواع دستگاه های الکتروریسی عمودی و افقی
روشهای تثبیت آنزیم با استفاده از نانوالیاف الکتروریسی
در سالهای اخیر، با توسعه نانومواد و فناوری الکتروریسی، تحقیقات بر روی آنزیمهای تثبیت شده با استفاده نانوالیاف الکتروریسی، پیشرفت زیادی داشته است. ثابت شده است که نانوالیاف الکتروریسی شده بستر عالی برای تثبیت آنزیم هستند، چراکه میتوانند نسبت سطح به حجم بالا، اندازه منافذ متناسب با ابعاد مولکول پروتئین، سطوح عاملدار، مکانهای متعدد برای تعامل یا اتصال آنزیم و کاهش محدودیت انتقال جرم را ارائه دهند(11). نانوالیاف حاوی آنزیم در بسیاری از زمینهها از جمله تجزیه مواد آلاینده، بیوراکتورها، حسگرهای زیستی و غیره استفاده شدهاند. با توجه به روش ساخت نانوالیاف الکتروریسی شده و ویژگیهای ذاتی آنها، دو روش اصلی تثبیت آنزیمی برای نانوالیاف الکتروریسی شده وجود دارد: 1- انکپسولاسیون، 2- اتصال سطحی.
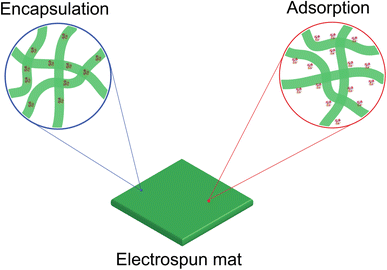
شکل 2 الیاف الکتروریسی و تثبیت آنزیم به روش انکپسولاسیون (سمت چپ) و اتصال سطحی (سمت راست)
تثبیت آنزیم با روش انکپسولاسیون در نانوالیاف الکتروریسی
محصور کردن آنزیمها در نانوالیاف را میتوان با افزودن مستقیم آنزیمها به محلول الکتروریسی در طی فرآیند تهیه نانوالیاف به دست آورد. بیشتر پروتئینها فقط در محیطهای آبی قابل حل هستند. بنابراین، در بسیاری از موارد، پلیمرهایی که قرار است با آنزیمها به صورت همزمان الکتروریسی شوند، باید محلول در آب باشند تا بتوانند محلول همگنی با آنزیمها تشکیل دهند (12). پلیمرهای رایج مورد استفاده شامل بیوپلیمرها همراه با پلیوینیل الکل(PVA) ، پلیاتیلن اکسید (PEO) و پلیان-وینیل پیرولیدون (PVP) میباشند. این پلیمرها به صورت تجاری با قیمت مناسب در دسترس هستند و میل ترکیبی خوبی با آنزیمها دارند (12).
از مزایای اصلی روش انکپسولاسیون میتوان به ظرفیت بارگذاری زیاد آنزیم، عدم آسیب به ساختار آنزیم، آسان و تک مرحلهای بودن آن اشاره کرد.
البته در مقابل مزایای ذکر شده، روش انکپسولاسیون دارای معایبی است:
1- مولکولهای آنزیم نه تنها درون نانوالیاف جاسازی میشوند، بلکه روی سطح نیز قرار میگیرند که معمولاً منجر به از دست دادن آنزیمها در طول اندازهگیری و نگهداری میشود.
2- از آنجایی که بیشتر مولکولهای آنزیم در داخل الیاف غیر متخلخل محبوس میشوند، دسترسی سوبسترا به آنزیم مهار میشود.
3- پلیمرهایی که میتوانند با آنزیمها الکتروریسی شوند فقط به چندین نوع محدود میشوند چرا که الکتروریسی حتی از محلول همگن نیز منجر به تولید نانوالیاف با گره میشود (23).
4- هنگامی که نانوالیاف آبدوست تولید شده در محیط آبی غوطه ور میشوند، حلالیت در آب منجر به متورم شدن و متلاشی شدن نانوالیاف میشود و در نتیجه نشت آنزیم، ناپایداری حرارتی و قابلیت استفاده مجدد ضعیف ایجاد میشود.
5- زمانی که از ایجاد اتصال عرضی برای افزایش پایداری آنزیمهای محصور شده به روش فیزیکی استفاده میشود باعث کاهش فعالیت آنزیمهای تثبیت شده میشود .از یک طرف، ایجاد اتصال عرضی میتواند فاصله بین الیاف را کاهش دهد، که دسترسی سوبسترا به مکان های فعال آنزیمها را محدود می کند. از سوی دیگر، خود اتصال عرضی به مکانهای فعال آنزیمها آسیب میرساند.
6- زمانیکه پلیمرهای نامحلول در آب برای الکتروریسی همزمان با آنزیمها مورد استفاده قرار میگیرند به علت اینکه تعداد زیادی از پلیمرهای نامحلول در آب مانند پلیاستایرن، پلیاکریلونیتریل، پلیسولفون، زیست سازگاری ضعیف دارند و همچنین برای الکتروریسی آنها نیاز به استفاده از حلالهای شیمیایی میباشد، منجر به تغییر ساختاری نامطلوب آنزیمها و کاهش فعالیت میشوند (12).
تثبیت آنزیم با روش اتصال سطحی بر روی نانوالیاف الکتروریسی
این روش تثبیت آنزیم به سه صورت انجام میشود: 1- جذب فیزیکی بر روی سطح نانوالیاف 2- اتصال شیمیایی آنزیم بر روی سطح نانوالیاف 3- اتصال عرضی آنزیم بر روی سطح نانوالیاف
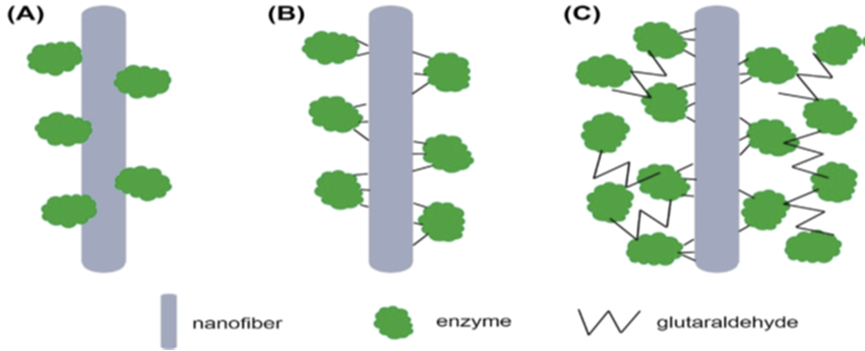
شکل 3 نمایش شماتیک اتصال سطحی آنزیم بر روی نانوالیاف: (A) جذب فیزیکی، (B) اتصال شیمیایی، (C) تثبیت با ایجاد اتصال عرضی توسط گلوتارآلدئید
جذب فیزیکی بر روی سطح نانوالیاف
روش جذب فیزیکی یک فرآیند ساده میباشد که از طریق برقراری پیوندهای واندروالسی (الکترواستاتیک، هیدروفوبی یا هیدروفیلی) بین الیاف به عنوان بستر و آنزیم اتفاق میافتد (24). نوع این پیوندها به بقایای اسید آمینه سطح آنزیم بستگی دارد که پیوندهای هیدروژنی یا برهمکنشهای قطبی با گروههای عاملی پلیمر را تشکیل میدهند (12). عیب این روش این است که مولکولهای آنزیم تثبیتشده بهدلیل نیروهای اتصال نسبتا ضعیف به راحتی در هنگام استفاده از آنها شسته و از الیاف جدا میشوند که بر قابلیت استفاده مجدد آنزیمهای تثبیت شده تأثیر منفی میگذارد (23).
اتصال شیمیایی آنزیم بر روی سطح نانوالیاف
روش دیگر برای تثبیت آنزیمها در سطح خارجی الیاف الکتروریسی شده، اتصال شیمیایی است. برای غلبه بر مشکل رها شدن آنزیم از سطح الیاف، اغلب گروههای عاملی فعال موجود روی سطوح نانوالیاف الکتروریسی شده برای تثبیت آنزیم اصلاح میشوند. در این مورد، عامل اصلی بین بستر و مولکول آنزیم، پیوند شیمیایی است (24). اتصالات کووالانسی، پیوندهای قوی و پایداری را تشکیل میدهند که از نشت آنزیم جلوگیری میکند و در نتیجه پایداری آنزیمهای تثبیت شده را تا حد زیادی بهبود میبخشد و باعث ایجاد یک بیوکاتالیست قوی میشود. با این حال، تشکیل پیوندهای کووالانسی به طور کلی فعالیت آنزیم را کاهش میدهد و تثبیت موثر مقدار زیادی از آنزیم را دشوار میکند (11).
ایجاد اتصال عرضی بر روی سطح نانوالیاف
پیشرفتهای اخیر در تثبیت آنزیم بر روی الیاف الکتروریسی شده شامل پوشش[5] آنزیمی روی الیاف است، این پوششهای آنزیمی به طور کلی با ترکیب روش جذب و اتصال کووالانسی آنزیمها بر روی الیاف الکتروریسی شده به دست میآیند (شکل 1-6). اولین ردیف از آنزیمهای جذب شده بر روی سطح نانوالیاف به عنوان لایه برای تودههای آنزیمی عمل میکنند که به صورت متقاطع توسط اتصال دهنده های عرضی مانند گلوتارآلدهید به هم متصل میشوند. در این روش نیز احتمال آسیب به ساختار آنزیم از طرف اتصال دهنده عرضی وجود دارد (23).
نتیجهگیری:
نانوالیاف الکتروریسی پشتیبان بسیار خوبی برای تثبیت آنزیم هستند زیرا می توانند نسبت های سطح به حجم بالاتر، اندازه منافذ متناسب با ابعاد مولکول پروتئین، سطوح عامل دار، مکان های متعدد برای تعامل یا اتصال و محدودیت انتقال جرم کم را ارائه دهند. با این حال، مطالعات این موضوع همچنان محدود است، زیرا هنوز مشکلاتی در کاربرد گسترده آنها به علت محدودیت تولید انبوه وجود دارد. با این وجود، بر اساس مزایای منحصر به فرد آنها، می توان پیش بینی کرد که سیستم های بیوکاتالیستی حاصل، استفاده های جدید و گسترده ای از آنزیم ها را در کاربردهای عملی مانند حسگرهای زیستی، زیست پزشکی، صنایع غذایی و شیمی ممکن می سازد.
[1] Electrostatic spinning
[2] Collector
[3] Taylor Cone
[4] Jet
[5] Coating
شقایق شیخ زاده*1، محمد علیزاده خالد آباد 1 ، هادی الماسی1
گروه علوم و صنایع غذایی، دانشکده کشاورزی، دانشگاه ارومیه1
منابع:
1) Novick, S. J., & Rozzell, J. D. (2005). Immobilization of enzymes by covalent attachment. Microbial enzymes and biotransformations, 247-271.
2) Brena, B., González-Pombo, P., & Batista-Viera, F. (2013). Immobilization of enzymes: a literature survey. Immobilization of Enzymes and Cells: Third Edition, 15-31.
3) Homaei, A. A., Sariri, R., Vianello, F., & Stevanato, R. (2013). Enzyme immobilization: an update. Journal of chemical biology, 6, 185-205.
4) Selvarajan, E., Nivetha, A., Subathra Devi, C., & Mohanasrinivasan, V. (2019). Nanoimmobilization of β-galactosidase for lactose-free product development. Nanoscience and Biotechnology for Environmental Applications, 199-223.
5) Deka, J. R., Saikia, D., Lai, Y.-S., Tsai, C.-H., Chang, W.-C., & Kao, H.-M. (2015). Roles of nanostructures and carboxylic acid functionalization of ordered cubic mesoporous silicas in lysozyme immobilization. Microporous and Mesoporous Materials, 213, 150-160.
6) Kumar, V., Misra, N., Paul, J., Dhanawade, B., & Varshney, L. (2014). Uricase-immobilization on radiation grafted polymer support for detection of uric acid using Ag-nanoparticle based optical biosensor. Polymer, 55(11), 2652-2660.
7) hen, Q., Yang, R., Hua, X., Ye, F., Zhang, W., & Zhao, W. (2011). Gelatin-templated Biomimetic calcification for β-galactosidase immobilization. Process Biochemistry, 46(8), 1565 1571.
8) Verma, M. L., Barrow, C. J., & Puri, M. (2013). Nanobiotechnology as a novel paradigm for enzym immobilisation and stabilisation with potential applications in biodiesel production. Applie Microbiology and Biotechnology, 97, 23-39.
9) Zhao, L.-M., Shi, L.-E., Zhang, Z.-L., Chen, J.-M., Shi, D.-D., Yang, J., & Tang, Z.-X. (2011). Preparation and application of chitosan nanoparticles and nanofibers. Brazilian Journal of Chemical Engineering, 28, 353-362.
10) Jia, H., Zhu, G., Vugrinovich, B., Kataphinan, W., Reneker, D. H., & Wang, P. (2002). Enzyme‐carrying polymeric nanofibers prepared via electrospinning for use as unique biocatalysts. Biotechnology progress, 18(5), 1027-1032.
11) Jia, H. (2011). Enzyme-carrying electrospun nanofibers. Nanoscale biocatalysis: methods and protocols, 205-212.
12) Wang, Z.-G., Wan, L.-S., Liu, Z.-M., Huang, X.-J., & Xu, Z.-K. (2009). Enzyme immobilization on electrospun polymer nanofibers: An overview. Journal of Molecular Catalysis B: Enzymatic, 56(4), 189-195.
13) Ahmad, R., & Sardar, M. (2015). Enzyme immobilization: an overview on nanoparticles as immobilization matrix. Biochemistry and Analytical Biochemistry, 4(2), 1.
14) Tran, D. N., & Balkus, K. J. (2012). Enzyme immobilization via electrospinning. Topics in Catalysis, 55, 1057-1069.
15) Ondarçuhu, T., & Joachim, C. (1998). Drawing a single nanofibre over hundreds of microns. Europhysics letters, 42(2), 215.
16) Alghoraibi, I., & Alomari, S. (2018). Different methods for nanofiber design and fabrication. Handbook of nanofibers, 1-46.
17) Liang, H. W., Guan, Q. F., Chen, L. F., Zhu, Z., Zhang, W. J., & Yu, S. H. (2012). Macroscopic‐ scale template synthesis of robust carbonaceous nanofiber hydrogels and aerogels and their applications. Angewandte Chemie International Edition, 51(21), 5101-5105.
18) Bezerra, M. A., Santelli, R. E., Oliveira, E. P., Villar, L. S., & Escaleira, L. A. (2008). Responsesurface methodology (RSM) as a tool for optimization in analytical chemistry. Talanta, 76(5), 965-977.
19) Li, D., & Xia, Y. (2004). Electrospinning of nanofibers: reinventing the wheel? Advanced materials, 16(14), 1151-1170.
20) Chakraborty, S., Liao, I.-C., Adler, A., & Leong, K. W. (2009). Electrohydrodynamics: A facile technique to fabricate drug delivery systems. Advanced drug delivery reviews, 61(12), 1043-1054.
21) Bhardwaj, N., & Kundu, S. C. (2010). Electrospinning: A fascinating fiber fabrication technique. Biotechnology advances, 28(3), 325-347.
22) Schiffman, J. D., & Schauer, C. L. (2008). A review: electrospinning of biopolymer nanofibers and their applications. Polymer reviews, 48(2), 317-352.
23) Li, D., Wang, Q., Huang, F., & Wei, Q. (2019). Electrospun nanofibers for enzyme immobilization. In Electrospinning: Nanofabrication and Applications (pp. 765-781). Elsevier.
24) Liu, C., Saeki, D., & Matsuyama, H. (2017). A novel strategy to immobilize enzymes on microporous membranes via dicarboxylic acid halides. RSC advances, 7(76), 48199-48207.














